chapitre n°2 : LE COURANT ELECTRIQUE
I - LE COURANT ELECTRIQUE DANS UN METAL
1° ) Les métaux sont conducteurs


2 ) La nature du courant électrique
Un métal est constitué d'atomes. Dans ces atomes, les électrons périphériques sont peu liés au noyau. Ils peuvent quitter leur atome d'origine et passer sur les atomes voisins : on les appelle des électrons libres. (voir figure n°1).
a ) Voir fig. n°1 : Lorsque le conducteur métallique n'est soumis à aucune tension, les électrons libres de ce conducteur ont un mouvement désordonné : ils se déplacent en tous sens.
b ) Voir fig. n°2 : Lorsque le conducteur métallique est soumis à une tension électrique, les électrons libres ont un mouvement d'ensemble dans le même sens, de la borne - à la borne + du générateur. Le sens de déplacement des électrons est donc opposé au sens conventionnel du courant. En effet, au XIXème siècle, les physiciens, ignorant l'existence des électrons libres, ont choisi arbitrairement un sens pour le courant : le courant va de la borne + à la borne - à l'extérieur du générateur. Dans les métaux, le courant électrique est dû à un déplacement de porteurs de charges négatives : les électrons libres.
Remarque n°1: Parmi les électrons que possède un isolant, il n'y a pas d'électrons libres. Tous les électrons d'un isolant sont liés au noyau. C'est pour cette raison qu'un isolant électrique ne conduit pas le courant électrique.
Remarque n°2: L'intensité I du courant correspond à un débit d'électrons, c'est-à-dire au nombre d'électrons libres qui passent dans un conducteur pendant un temps donné. Plus le nombre d'électrons qui passent en 1 seconde est grand, plus l'intensité I est élevée.
Dans les métaux, le courant électrique est dû à un déplacement de porteurs de charges électriques négatives : les électrons libres.
II - LE COURANT ELECTRIQUE DANS LES SOLUTIONS
1° ) Expérience : tests de la conduction de quelques solutions

intensité gravée sur le culot : 50 mA
C'est l'intensité nominale (intensité pour laquelle la lampe brille normalement)
|
liquides testés
|
état de la lampe (allumée ou éteinte) |
intensité
I en mA
|
Conclusion (solution
non, peu ou très conductrice du courant).
|
| Eau du robinet | faiblement allumée | peu conductrice | |
| eau salée | allumée | très conductrice | |
| eau distillée | éteinte | pas conductrice | |
|
eau sucrée (préparée avec de l'eau distillée) |
éteinte | pas conductrice | |
|
solution de sulfate de cuivre Cu2+ + SO42- |
allumée |
très conductrice |
|
| huile | éteinte | pas conductrice |
2° ) Interprétation : les porteurs de charge dans les solutions
a ) L'eau distillée est une eau qui contient des ions en quantité négligeable. On constate que l'eau distillée ne laisse quasiment pas passer le courant électrique.
b ) Par contre, l'eau salée (solution aqueuse de chlorure de sodium Na+ + Cl -) est une solution conductrice car elle contient des ions. Idem pour la solution aqueuse de sulfate de cuivre Cu2+ + SO42-.
c ) L'eau sucrée ne conduit pas le courant car l'eau contient des molécules de saccharose de formule C12H22O11, donc pas de charges électriques + et - puisqu'une molécule est électriquement neutre. Idem pour l'huile qui ne contient que des molécules.
Le courant électrique dans une solution aqueuse est dû à la
migration d'ions. Les ions sont les porteurs de charge électrique
dans une solution.
3° ) Etude de la migration des ions d'une solution

La solution de dichromate de potassium (2K+ + Cr2O72-) est de couleur jaune.
La solution de sulfate de cuivre (Cu2+ + SO42-) est de couleur bleue.
On mélange ces 2 solutions : la solution obtenue est de couleur verte.
Remplissons un tube en U avec cette solution verte.
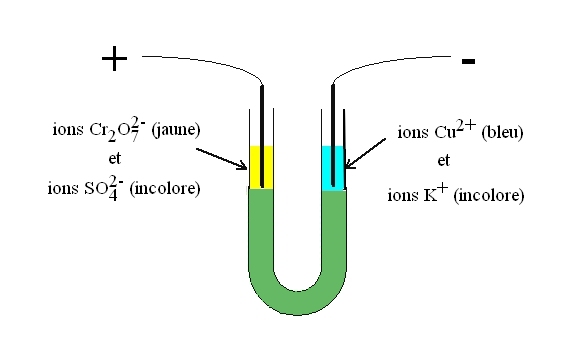
Introduisons une électrode dans chaque branche du tube en U, et relions les à un générateur de courant continu.
Après quelques minutes, une coloration jaunâtre apparaît à l'électrode reliée au +, et une coloration bleue apparaît àl'électrode reliée à la borne -.
Explique l'origine de ces colorations.
Les ions dichromate Cr2O72-, de couleur jaune et de signe -, sont attirés par l'électrode positive, d'où la présence de l'anneau jaune à l'électrode +.
Les ions cuivre Cu2+, de couleur bleue et de signe +, sont attirés par l'électrode négative, d'où la présence de l'anneau bleu à l'électrode -.
Remarque : Les ions sulfate SO42- et potassium K+ sont tous les deux incolores, donc on ne se rend pas compte visuellement de leur migration.
SO42- migre vers l'électrode positive (+) et K+ migre vers l'électrode négative (-).