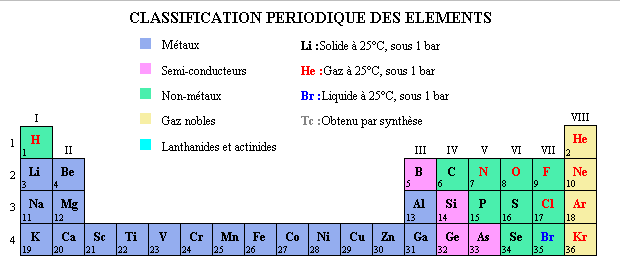
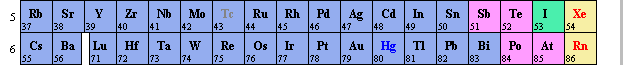
I - HISTORIQUE DES MODELES DE L'ATOME
II - LA CONSTITUTION DES ATOMES
1°) dimension de l'atome
La dimension de l'atome est de l'ordre du dixième de nanomètre, c'est-à-dire 10-10m.
|
kilo
|
hecto
|
déca
|
déci
|
centi
|
milli
|
|
|
1000
|
100
|
10
|
1
|
0,1
|
0,01
|
0,001
|
|
103
|
102
|
101
|
100
|
10-1
|
10-2
|
10-3
|
Tu as appris ce tableau à l'école primaire. Maintenant, tu dois savoir qu'il se prolonge à gauche et à droite.
|
méga
|
kilo
|
milli
|
micro
|
nano
|
|||||||||||
|
106
|
105
|
104
|
103
|
102
|
101
|
100
|
10-1
|
10-2
|
10-3
|
10-4
|
10-5
|
10-6
|
10-7
|
10-8
|
10-9
|
Remarque : Certaines colonnes ne correspondent pas à un nom de préfixe, mais ces colonnes existent réellement. Lorsque l'utilise de grandes unités (puissances de 10 positives), on compte de 103 en 103. Et lorsque l'on utilise de petites unités (puissances de 10 négatives), on compte de 10-3 en 10-3.
A retenir :
|
giga : 109 méga : 106 kilo : 103 milli : 10-3 micro : 10-6 nano : 10-9
|
Remarque : Attention à ne pas confondre les écritures des unités millimètre (mm) et nanomètre (nm) !
Vérifions qu'un dixième de nanomètre correspond à 10-10 m :
un dixième correspond à 1 / 10 = 0,1 = 10-1 et on vient d'apprendre que 1 nm = 10-9 m,
Donc : 1 / 10 nm = 10-1 . 10-9 m = 10-10 m
|
Rappel mathématiques : 10a x 10b = 10(a+b) 1 / 10a = 10-a 10a / 10b = 10(a-b) |
La dimension de l'atome est de l'ordre du dixième de nanomètre, c'est-à-dire 10-10m.


Atomes d'or vus au microscope électronique
2°) les constituants de l'atome
Un atome est constitué d'un noyau autour duquel se déplacent des électrons.

a ) l'électron
- Tous les électrons sont identiques qu'ils proviennent d'un même atome ou d'atomes différents.
- L'électron a une charge électrique négative.
b ) le noyau
Le noyau contient des particules, appelées protons, ayant une charge électrique positive.
Le nombre de charges positives est indiqué par le numéro atomique Z. Les valeurs des numéros atomiques Z sont inscrits dans la classification périodique.
Le nombre de charges positives caractérise un type donné d'atome. Par exemple, tous les atomes dont les noyaux ont 6 charges positives sont tous des atomes de carbone. Tous les atomes dont les noyaux ont 26 charges positives sont tous des atomes de fer.
- Contrairement aux électrons qui sont tous identiques, tous les noyaux ne sont pas les mêmes car ils ne contiennent pas le même nombre de charges positives.
- La masse d'un noyau vaut des milliers de fois celle de l'électron, donc presque toute la masse de l'atome est concentrée dans le noyau. Et le noyau est quasi-immobile.
3°) l'électroneutralité de l'atome
Un atome possède autant de charges négatives (c'est-à-dire d'électrons) que
de charges positives (c'est-à-dire de protons).
Exemple de l'atome de fer : Z = 26.
L'atome de fer possède donc 26 charges (+) dans le noyau et 26 électrons (-) .
charge de l'atome = charge du noyau + charge des électrons
donc, charge de l'atome Fe = 26(+) + 26(-) = 0
|
carbone
|
cuivre
|
fer
|
aluminium
|
azote
|
soufre
|
hydrogène
|
oxygène
|
|
| symbole |
C
|
Cu
|
Fe
|
Al
|
N
|
S
|
H
|
O
|
| numéro atomique Z |
6
|
29
|
26
|
13
|
7
|
16
|
1
|
8
|
| nombre d'électrons |
6
|
29
|
26
|
13
|
7
|
16
|
1
|
8
|
Conclusion :
La charge totale d'un atome est nulle : un atome est électriquement neutre.
La matière étant constituée d'atomes est donc électriquement neutre.
III - LES IONS
1°) Quelques ions
|
Nom des ions positifs (cations) |
Formule
|
| hydrogène |
H+
|
| sodium |
Na+
|
| fer II |
Fe2+
|
| fer III |
Fe3+
|
| aluminium |
Al3+
|
| cuivre II |
Cu2+
|
| zinc |
Zn2+
|
Exercice pour vérifier que tu connais les formules des ions
|
Nom des ions négatifs (anions) |
Formule
|
| sulfate | SO42- |
| nitrate | NO3- |
| carbonate | CO32- |
| chlorure | Cl- |
| hydroxyde | HO- |
2°) Ion monoatomique
Un ion est monoatomique s'il est formé à partir d'un seul atome.
exemples : ion chlorure Cl- ; ion calcium Ca2+ ; ion potassium K+
3°) Ion polyatomique
Un ion est polyatomique s'il est formé à partir d'un groupement d'atomes.
exemples : ion permanganate : MnO4- ; ion ammonium NH4+ ; ion sulfate SO42-
4°) Nombre d'électrons d'un ion négatif
a ) cas de l'ion fluorure F- :
b ) cas de l'ion oxygène O2- :
c ) cas de l'ion chlorure Cl- :
d ) cas de l'ion iodure I- :
Le numéro atomique de l'iode I est Z = 53.
L'atome d'iode I possède donc 53 charges (+) et 53 électrons (-).
L'ion iodure I - possède 53 + 1 = 54 électrons.
e ) cas de l'ion sulfate SO42- :
Calculons le nombre d'électrons que possède l'ion sulfate, qui est un ion polyatomique, sachant qu'il contient 1 atome de soufre et 4 atomes d'oxygène et que les numéros atomiques sont : Z = 16 pour le soufre et Z = 8 pour l'oxygène.
1 atome de soufre contient 16 électrons
4 atomes d'oxygène contiennent : 4 x 8 = 32 électrons
Ne pas oublier que la charge (2-) signifie la présence de 2 électrons en excès,
Soit un total de : 16 + 32 +2 = 50 électrons.
conclusion : l'ion sulfate possède 50 électrons.
f ) conclusion:
Un ion négatif possède un nombre d'électrons supérieur à celui de l'atome ou
du groupement d'atomes correspondants.
5°) Nombre d'électrons d'un ion positif
a ) cas de l'ion aluminium Al3+ :
b ) cas de l'ion sodium Na+ :
c ) cas de l'ion hydrogène H+ :
d ) cas de l'ion calcium Ca2+ :
Le numéro atomique du calcium est Z = 20.
L'atome de calcium Ca possède donc 20 charges (+) et 20 électrons (-).
L'ion calcium Ca2+ possède 20 - 2 = 18 électrons.
e ) cas de l'ion ammonium NH4+ :
Calculons le nombre d'électrons que possède l'ion ammonium, qui est un ion polyatomique, sachant qu'il contient 1 atome d'azote et 4 atomes d'hydrogène et que les numéros atomiques sont : Z = 7 pour l'azote et Z = 1 pour l'hydrogène.
1 atome d'azote contient 7 électrons
4 atomes d'hydrogène contiennent : 4 x 1= 4 électrons
Ne pas oublier que la charge (+) signifie un défaut de 1 électron,
Soit un total de : 7+ 4 -1 = 10 électrons.
conclusion : l'ion ammonium possède 10 électrons.
f ) conclusion:
Un ion positif possède un nombre d'électrons inférieur à celui de l'atome ou
du groupement d'atomes correspondants.
6°) Le noyau des ions
Le noyau d'un ion est identique à celui de l'atome correspondant. L'ion et l'atome correspondant possèdent le même nombre de charges positives dans leur noyau.
EXERCICE : "Trouve la formule de l'ion à l'aide des indices et de la classification périodique"
IV - NOM ET FORMULE D'UN COMPOSE IONIQUE EN SOLUTION
Un composé ionique en solution est formé d'ions positifs et d'ions négatifs.
Le nombre d'ions positifs et négatifs est tel que la solution soit électriquement neutre.
Remarque : Dans la formule du composé ionique, on écrit d'abord les ions positifs, puis les ions négatifs. L'ordre est inversé dans le nom du composé.
*Le chlorure de sodium est le nom scientifique du sel. Sa formule s'écrit : Na+ + Cl-. Dans le sel, il y a 1 ion sodium pour 1 ion chlorure, soit 50% de chaque.
*L'hydroxyde de sodium est le nom scientifique de la soude Sa formule s'écrit : Na+ + HO-
* La formule du chlorure de zinc est : Zn2+ + 2 Cl-. Dans le chlorure de zinc, les ions chlorure sont 2 fois plus nombreux que les ions zinc. La solution est ainsi électriquement neutre, car la charge (2+) de l'ion zinc Zn2+ est compensée par celle apportée par les 2 ions chlorure Cl-.
Il est important de faire l'exercice ci-dessous pour aprendre à placer les coefficients devant les ions pour que le composé ionique soit neutre.
EXERCICE : (Attention, pour des raisons informatiques, même les chiffres 1 doivent être écrits, ce que l'on ne fait jamais en chimie ! Le chiffre 1 est toujours "sous-entendu" en chimie. Mets les coefficients 1 juste pour cet exercice, mais ne le fais surtout pas le jour du contrôle sur ta copie !